導讀:仿制藥產業在我國醫藥領域具有重要地位,對提高藥品可及性、降低醫療成本、促進醫療健康服務均衡發展起到了不可替代的作用。
為促進我國仿制藥產業的高質量發展,中國醫學科學院藥物研究所、中國醫藥工業信息中心和中國食品藥品檢定研究院聯合編著推出了《中國仿制藥發展報告(2023版)》。本報告在農工黨中央的倡導下,立足于客觀、全面、深入地呈現中國仿制藥行業的發展態勢,旨在為政府決策、企業戰略規劃、學術研究提供科學依據和參考。

本報告包含化學仿制藥(含市場概況、一致性評價進展、國家集采情況等)、生物類似藥(上市概況、研發進展、集采情況等)以及發展展望3大部分,報告共計29頁。歡迎感興趣的朋友掃描文末二維碼,免費下載收藏!

化學仿制藥市場份額持續走低
2018年以來,我國加速了醫藥創新的步伐,上市的進口原研藥物和國產自研藥激增,創新藥市場規模穩步增加。同時,醫保基金“騰籠換鳥”的效應顯現,我國藥品市場結構發生改變。化學仿制藥的市場份額持續走低,在整體藥品市場中從60%下滑至52%,在化學藥市場中從79%下滑至74%。
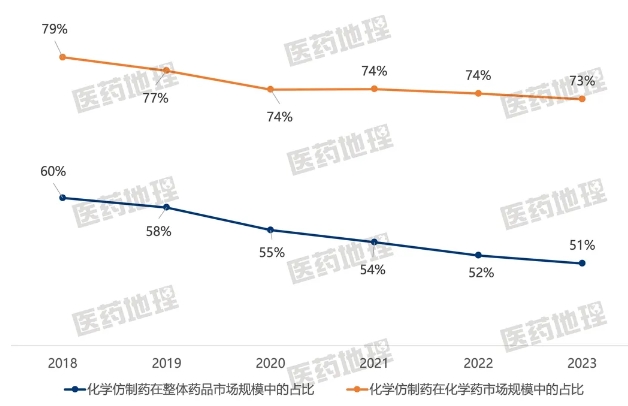
圖1:2018-2023年中國化學仿制藥在整體藥品市場規模中的占比
高壁壘仿制藥取得突破
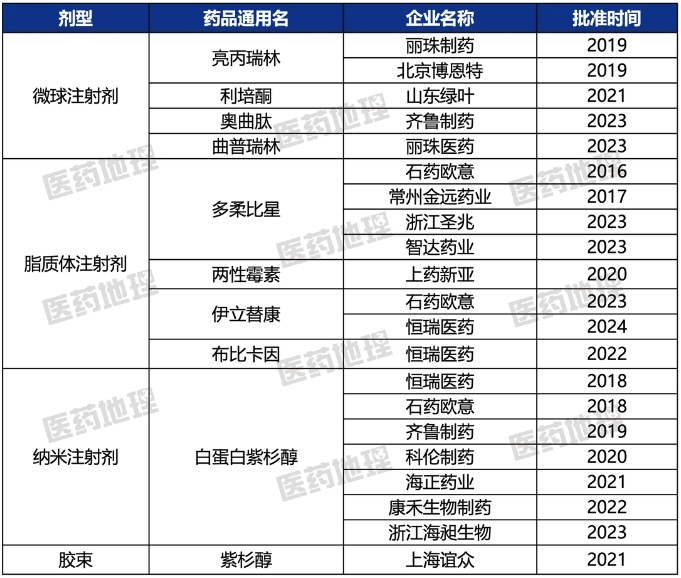
隨著國內仿制藥市場的競爭加劇,技術壁壘較高的復雜制劑如納米制劑、脂質體以及微球等,得到企業更多關注。與此同時,多個復雜制劑原研藥的專利到期,頭部企業正加速布局,推動此類高壁壘仿制藥研發技術壁壘的突破。國家監督管理局發布《納米藥物質量控制研究技術指導原則》、《脂質體藥物質量控制研究技術指導原則》等十余份復雜制劑的技術指導原則,規范和加速企業研發進程。2023年,奧曲肽微球注射劑、曲普瑞林微球注射劑和伊立替康脂質體注射劑成功獲批,標志著我國高壁壘仿制藥研發和產業化能力的持續提升。
表1:2016年以來我國已獲批上市化學仿制藥中復雜制劑品種
生物類似藥市場份額逐年提升,申請數量亦屢創新高
生物藥在國內具有廣泛的治療需求。但受限于價格因素,其在國內可及性長期處于較低水平。生物類似藥的出現使得生物藥的需求得到進一步釋放。由于同時具備低廉的價格和媲美原研的療效,生物類似藥備受市場青睞,呈現蓬勃的發展態勢。以抗體生物類似藥為例,其在抗體類藥物的市場份額占比從2019年的0.5%快速攀升至2022年的27%,如今已成為抗體類藥物市場的重要組成部分。
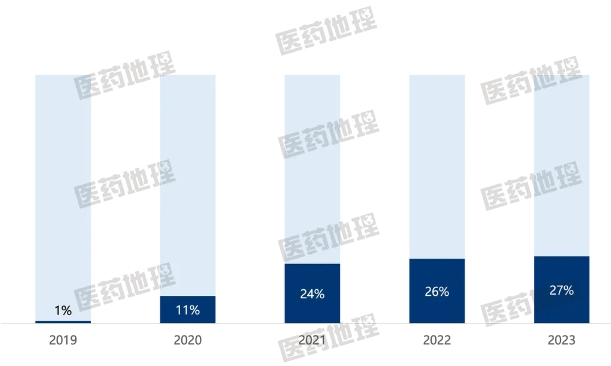
圖2:2019-2023年抗體生物類似藥在抗體類藥物市場份額占比
生物類似藥除了在市場端表現優異外,在研發端同樣十分活躍。自2020年新注冊管理辦法實施以來,國內在研的生物類似藥數量逐年上升。2023年,CDE受理的3.3類申請達69件,創下新高。
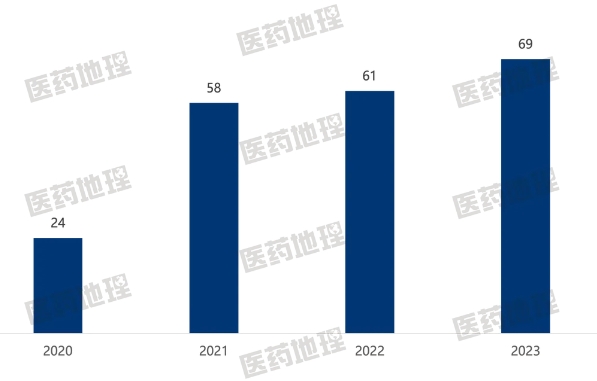
圖3:2020-2023年CDE受理的生物類似藥注冊申請數量
小結
當前,我國仿制藥已進入高質量發展的新時期,戰略機遇和挑戰并行。一方面市場競爭日趨激烈,化學仿制藥市場規模有所下降,仿制藥企業的未來發展面臨挑戰;但同時我們也應看到挑戰背后的機遇,近年來生物類似藥申請數量屢創新高,部分重磅獨家品種專利到期后吸引大量企業仿制,同時我國也在微球、脂質體等復雜制劑仿制上取得突破,實現了仿制藥的良性循環與創新發展。