

高飛還是高跌?美國市場的考驗
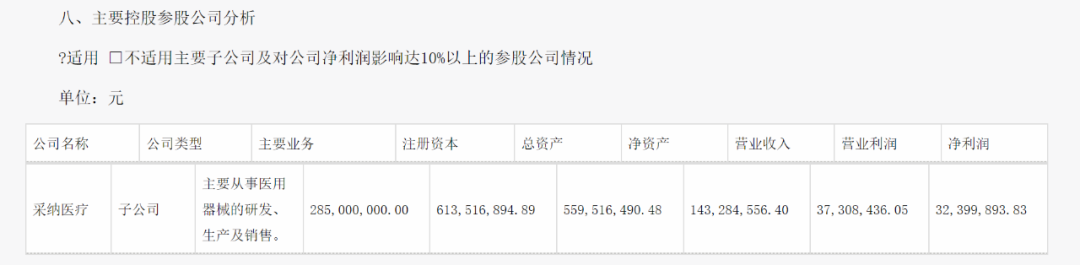
圖片來自采納股份2023半年報
愈加嚴格,中企美市考驗加碼

2024-04-24
237次瀏覽HIGH END MEDICAL DEVICE EXHIBITION





06-06 16

06-05 17

06-04 39

06-03 34
05-30 47

05-29 36

05-28 71

05-27 48

05-26 52

05-26 44
05-23 30

05-22 38

05-21 40

05-20 0

05-20 62

05-19 50

05-16 52
05-15 38

05-14 72
05-13 37
Copyright ? 2025 www.hrbopzs.cn All Rights Reserved 2025第九屆廣州國際高端醫療器械展覽會
服務熱線:4008-4007-85 | 備案號:滬ICP備2021020415號-2