全年多項重磅NDA,諾誠健華的商業化藍圖
2024-05-16
202次瀏覽高醫展展期
HIGH END MEDICAL DEVICE EXHIBITION
最新活動
最新動態
-

從0到1!「6款」國產器械進入創新通道
06-06 16
-

歐盟:禁止中國械企參與招標
06-05 17
-

降幅60.8%,醫療設備集采結果公布
06-04 39
-

5695萬元,聯影又雙叒叕中標了!
06-03 34
-
官方發文,這類設備不集采
05-30 47
-

從腰斬到暴漲,2025骨科“深蹲起立”
05-29 36
-

邁瑞醫療,獨家中標320臺
05-28 71
-

148套CT集采,影像人工智能進入“免費”時代?
05-27 48
-

降價超40%!醫療設備集采來了
05-26 52
-

5類耗材集采來了,最低價聯動「松綁」
05-26 44
-
部分省份CT、磁共振檢查費用下調 醫保價格立項讓收費更規范
05-23 30
-

國產廠商,狂攬醫療設備大單!
05-22 38
-

即將啟動FDA申報,1款醫療器械完成首例人體臨床試驗
05-21 40
-

2025高醫展-參展商手冊
05-20 0
-

國產占比97%!骨科手術器械中標分析報告
05-20 62
-

降價潮?影像設備采購被徹查
05-19 50
-

5月21日開標! 醫療設備新訂單來了
05-16 52
-
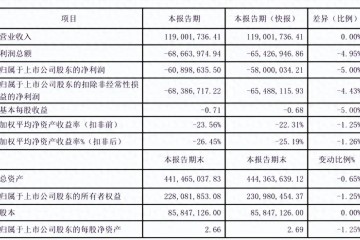
凈利降416%,國產影像核心部件龍頭如何突圍?
05-15 38
-

國產光學巨頭:內窺鏡核心技術重大突破
05-14 72
-
影像設備市場回暖,國產影像先驅如何破局?
05-13 37